Скачать реферат
Лечение больных с гнойно-воспалительными процессами в челюстно-лицевой области.
План комплексного лечения больных с гнойно-воспалительными заболеваниями лица и шеи зависит от возраста больного, общего и иммунологического состояния организма, характера и тяжести местного патологического процесса (острота начала болезни, гипертермия, боль в области очага поражения, реакция сердечно-сосудистой системы, диурез), вида инфекции и ее патогенности, чувствительности возбудителей гнойного и гнилостно-некротического процесса к антибиотикам, а также лабораторных показателей (лейкоцитоз, лейкограмма, лейкоцитарный индекс интоксикации, СОЭ, уровень общего белка, соотношение белковых фракций и др.)
Лечение больных основано на комплексном проведении оперативных вмешательств и консервативных мероприятий. Терапевтический комплекс может быть условно подразделен на воздействия общего и местного характера.
Общая терапия обеспечивает борьбу с инфекцией и интоксикацией, восстановление нарушенного равновесия между организмом и средой, активирует неспецифические и специфические защитные силы организма, нормализует нарушенные функции органов и систем, усиливает регенеративные процессы тканей очага воспаления. Вряде случаев — коррекцию метаболизма, включающую антигипоксическую медикаментозную терапию (улучшение тканевого дыхания, удаление из тканей конечных продуктов метаболизма), восстановление нарушенного энергетического баланса (ослабление катаболической реакции, возмещение энергетических потерь), коррекцию кислотно-щелочного состояния (респираторный и метаболический ацидоз или алкалоз) и водно-электролитного равновесия (регулирование избытка или дефицита воды). Коррекция метаболических расстройств проводится комплексно при обязательном объективном контроле за клиническими, параклиническими и лабораторными показателями.
Местное лечение
| в острой фазе проводится для создания оттока гноя и экссудата из гнойного очага в челюстях и околочелюстных тканях, ускорения некролиза, ограничения зоны распространения воспаления, уменьшения внутритканевого давления, резорбции продуктов распада, а также для нормализации микроциркуляции, улучшения регенерации и создания неблагоприятных условий для жизнедеятельности микроорганизмов. | в подострой фазе проводится для устранения воспалительного очага, ускорения заживления послеоперационной раны мягких тканей лица, предупреждения функциональных нарушений (рубцовая контрактура). |
в хронической фазе направлено на устранение некротизированной костной ткани, активизацию ее регенерации, предупреждение рецидивов заболевания, переломов и деформации челюстей (касается одонтогенного остеомиелита челюсти). |
Таким образом, комплексная медикаментозная терапия гнойно-воспалительных заболеваний челюстно-лицевой области включает:
- Хирургические методы лечения
- Антибактериальная терапия (антибиотики широкого спектра, остео- и тканевотропные, сульфаниламидные препараты, препараты нитрофуранового ряда)
- Десенсибилизирующая терапия
- Иммунотерапия
- Общеукрепляющая терапия
- Физиотерапия
- Симптоматическая терапия
1. Хирургические методы лечения
Главным действием врача при лечении гнойно-воспалительных одонтогенных заболеваний является удаление причинного зуба (лечение его осуществляется только при наличии показаний) с последующим широким раскрытием гнойников и рациональным их дренированием. Многовековый опыт показывает, что основным методом лечения острой гнойной инфекции является хирургический. Несмотря на успехи, достигнутые в области консервативной терапии, главной задачей челюстно-лицевого хирурга является своевременное опорожнение гнойника, адекватное его дренирование и лечение гнойной раны.
Своевременность выбора наиболее оптимального срока для вскрытия гнойного очага имеет важное значение. Принцип сверхраннего вскрытия воспалительных инфильтратов (В.Ф. Войно-Ясенецкий) не нашел широкого применения , т.к. развитие не каждого воспалительного инфильтрата заканчивается образованием гнойника и при раннем рассечении инфильтрата мы можем не найти центр воспалительного очага. Также в результате рассечения состояние местных тканей ухудшается, т.к. происходит усиление эмиграции лейкоцитов в воспалительно-измененные ткани, увеличивается отек, ацидоз и др. Поэтому создаются условия для образования гноя в мягких тканях. После вскрытия участка гнойного расплавления наступает улучшение состояния больного и его выздоровление.
При проведении оперативного вмешательства в челюстно-лицевой области необходим выбор оптимального метода обезболивания, а также адекватная инфузионная терапия с использованием патогенетических средств коррекции нарушенного гомеостаза.
Специфика острых воспалительных процессов челюстно-лицевой области препятствует проведению адекватной анестезии. Этому способствует то, что патологический процесс локализуется в непосредственной близости к верхним дыхательным путям. Большое количество сосудов вызывает обширные отеки мягких тканей данной области, а большое количество нервных окончаний — значительную болезненность и наклонность к возникновению гортанно-глоточных рефлексов. Наличие больших слюнных желез, выводные протоки которых открываются в полость рта, ведет к рефлекторному повышению их функции. Вовлечение в воспалительный процесс жевательной мускулатуры ограничивает открывание рта, а мышц заднего отдела дна полости рта вызывает сужение ротоглотки, увеличение и дистальное смещение языка. Все это создает значительные сложности для врача-анестезиолога как в пред-, так и в послеоперационный период. Проведение оперативного вмешательства опасно, т.к. попадание слюны, крови и гноя в верхние дыхательные пути может привести к механической их обтурации и ларингоспазму.
По мнению А.А. Тимофеева, при проведении оперативных вмешательств у больных с флегмонами, которые локализуются в одной анатомической области, более целесообразным является местное обезболивание с премедикацией. Вскрытие флегмон, захватывающих две анатомические области и более, рекомендуется проводить под общим обезболиванием — нозофарингеальной инсуффляцией газонаркотической смеси. Можно применять и внутривенное обезболивание.
Общепринятым методом хирургического лечения острых гнойных воспалительных процессов челюстно-лицевой области является оперативное вскрытие гнойного очага. Операция носит неотложный характер. Задержка грозит не только распространением воспалительного процесса на смежные области и увеличением некротически измененных тканей, но и генерализацией процесса, что может повлечь за собой развитие сепсиса, медиастинита, тромбофлебита вен лица и синусов головного мозга, менингита, менингоэнцефалита.
При хирургическом вмешательстве, проводимом при абсцессах, причиной возникновения которых является патологический процесс, протекающий в зубах верхней челюсти, б большинстве случаев ограничиваются внутриротовым разрезом по переходной складке в пределах не менее 3 зубов. Скальпелем делают разрез до кости, а если гнойное содержимое не получают, то тупым путем проникают в мягкие ткани околочелюстной области. (У детей внутриротовые разрезы надо делать несколько выше переходной складки для избежания повреждения зачатков зубов.)
Вскрытие поверхностно расположенных гнойных очагов обычно не вызывает каких-либо затруднений, в отличие от опорожнения глубоко расположенных гнойников дна полости. Выраженная инфильтрация воспаленных тканей затрудняет топографо-анатомическую ориентировку. Для достаточной ориентации в анатомических образованиях, которые встречаются при рассечении тканей, необходим тщательный гемостаз. Недостаточно рассечь только инфильтрат, т. к. в результате нарушения демаркационного вала, без вскрытия гнойного очага, процесс может быстро прогрессировать и приобретать септическое течение. В сомнительных случаях, когда хирург не уверен в наличии гноя в очаге, можно прибегнуть к пункции (с диагностической целью), а, убедившись в том, что гной есть, можно провести широкое вскрытие гнойника.
Оперативные доступы при гнойных заболеваниях лица и шеи должны обеспечить косметическое и наименее травматичное обнаружение патологического очага с учетом хода ветвей лицевого нерва. Разрезы должны быть широкими для хорошей эвакуации экссудата, а при наличии затеков и гнойных карманов, где невозможно одним разрезом обеспечить достаточный отток, производят дополнительные разрезы (контрапертуры). — Рис. 1
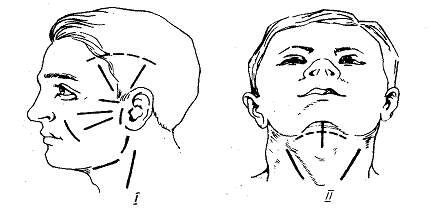
Рис. 1 Направление разрезов на лице (I) и шее (II) при вскрытии абсцессов и флегмон
Существуют различные приспособления для удаления гнойного содержимого и создания хорошего оттока для гноя. Имеет значение и материал, из которого изготовлен дренаж. При этом учитываются такие свойства, как гигроскопичность, капиллярность, смачиваемость, водонепроницаемость, пористость, бактерицидность и др. (Н. Г. Поляков 1978 г.). Наиболее часто используемые марлевые тампоны, смоченные гипертоническим раствором, эффективны только в течение первых 6 часов, т. к. пропитываются гноем и препятствуют оттоку экссудата (Н. Н. Петров 1912 г.), а в конце 1-х суток после пропитывания они оказывают обратное действие на течение раневого процесса.
Широкое распространение получили резиновые трубки. Но при длительном их нахождении в ране возникает воспалительная реакция, а из-за внутренней шероховатости поверхности резиновых трубок рана долго заживает, т.к. в порах задерживаются микроорганизмы. Поэтому в последнее время применяют гладкостенные трубки из синтетического материала (полиэтилен, полихлорвинил, силикон).
Резиновые полоски, которые применяются не менее широко, не в состоянии полноценно дренировать гнойный очаг, поэтому их можно применять лишь для предотвращения слипания краев раны.
Особое место занимает метод активного дренирования гнойных полостей путем создания в системе дренажа дозированного разрежения. Поэтому он получил также название метода активной аспирации в системе проточно-ирригационного орошения гнойно-воспалительных очагов.
В клинике нашел применение метод активного хирургического лечения гнойно-воспалительных очагов челюстно-лицевой области, который заключается в широком рассечении гнойного очага, тщательном иссечении некротизированных и нежизнеспособных тканей, дренировании его сдвоенным трубчатым дренажем, активным введением лекарственных растворов и принудительном отсасывании содержимого, раннем закрытии раны первичными или вторичными швами. Для дренирования глубоко расположенных гнойных очагов с узким входом А. А. Тимофеевым с соавт. предложен Y-образный сдвоенный трубчатый дренаж, который изготавливается из эластичных трубок, применяемых в одноразовых системах для переливания крови. (Трубки сгибаются вдвое, располагаются параллельно между собой и соединяются термическим способом. Отверстия, кот. делаются на рабочем конце приводящей и отводящей трубок дренажа, расположены на внутренне-боковой поверхности и не соприкасаются между собой. Отверстия, расположенные на приводящей части дренажа, располагаются между отверстиями отводящей его части — этим исключается соприкосновение их с раневой поверхностью и предохраняется от закупорки массами фибрина — рис. 2).
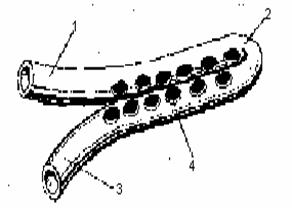 Рис. 2
Рис. 2 
Внешний вид сдвоенного трубчатого дренажа: Флакон с антисептиком (1), система для одноразового введения приводящая (1) и отводящая (3) трубки, рабония растворов (2), приводящая и отводящая трубки дренажа
чая часть (2), отверстия (4) (3,5), рабочая часть дренажа (4), вакуум-отсос (6,7)
В одну из трубок при помощи системы для переливания крови вводится орошающий раствор, а другая соединена с отсасывающим аппаратом для отведения жидкости из раны. После проведения каждого сеанса активного орошения гнойника лекарственными растворами, а оно повторяется 2-3 раза в сутки (в течение первых 2-х суток), рекомендуется удалять дренажное устройство из раны. Это легко осуществимо и не вызывает неприятных ощущений у больных. Длительное нахождение в ране любого трубчатого дренажа нежелательно, так как это затрудняет течение репаративных процессов. Для создания в системе замкнутой полости на послеоперационную гнойную рану накладываются первичные швы. Гнойную полость промывают в течение 1-2 ч, используя за один сеанс 1-1,5 л антисептического раствора. При этом необходимо следить за количеством вводимой в рану и оттекающей из нее жидкости.
После вскрытия гнойного воспалительного очага мягких тканей послеоперационная рана имеет две фазы течения раневого процесса: гнойно-некротическую и регенеративную
Учитывая недостатки открытого метода лечения гнойных ран, хирурги издавна предпринимали попытки лечить некоторые гнойные процессы закрытым способом, то есть путем наложения первичных и вторичных швов. Первичный шов - шов, накладываемый на рану непосредственно после ее первичной хирургической обработки (вскрытия гнойного очага) Первичный отсроченный шов - шов, наложенный на гнойную рану во время хирургической обработки, но затягиваемый через 24-72 часа при стихании клинических признаков воспаления, или шов, накладываемый на 2-7-е сутки после операции. Вторичный ранний шов — это шов, накладываемый на рану на 8-14-е сутки после операции без предварительного иссечения грануляций. Вторичный поздний шов — шов, накладываемый на рану 15-30 дневной давности после иссечения некротизированных участков кожи, грануляций, измененных тканей и мобилизации краев раны. На основании результатов исследования А. А. Тимофеева, можно утверждать, что цитологическое изучение ран может быть использовано как один из важнейших критериев наложения на рану вторичных швов.
Показанием для оперативного закрытия раны служит незначительная макрофагальная реакция, небольшое количество нейтрофилов и наличие в отпечатках жизнеспособных клеток соединительной ткани (гистиоцитов, фибробластов). Если же в отпечатках наблюдается большое количество нейтрофилов и активная макрофагальная реакция, то это служит противопоказанием для наложения швов. Противопоказанием для наложения первичных швов также служит невозможность удаления всех нежизнеспособных тканей, выраженные воспалительные изменения кожных покровов, значительная интоксикация у больных со снижением реактивности организма (сопутствующие заболевания, пожилой возраст), тяжелое течение гнойно-воспалительных процессов челюстно-лицевой области. Единственно возможный способ в этом случае — открытый способ лечения, несмотря на все его недостатки.
При наложении вторичных швов важно не оставлять полостей и карманов в глубине раны, особенно если имеются глубокие межмышечные раны с большими полостями.
Цитологическими исследованиями установлено, что в гнойно-некротической фазе раневого процесса наиболее рационально применять антимикробный препарат бализ-2, иммобилизованный лизоцим, 20% гель гранул кверцетина, многокомпонентные мази на гидрофильной основе (левосин, левонорсин, левомеколь), а в фазе образования грануляций и эпителизации (стадия регенерации) — лизоцим в чистом виде или иммобилизованный, 20% гель гранул кверцетина (А.А. Тимофеев, 1988).
Для проведения дегидратации тканей раны А.А. Левенец и соавт. (1986) используют лекарственное вещество, заключенное в капсулу из полимерной полупроницаемой мембраны (целлюлозная, цилиндрической формы, гофрированная оболочка), которая обеспечивает освобождение этого вещества с заданной скоростью, а источником энергии этого процесса является перепад концентраций препарата внутри капсулы и вне ее. Применение диализа с использованием свойств полупроницаемых мембран позволяет эффективно проводить дегидратацию тканей, дезинтоксикацию организма и осуществлять дозированное введение лекарств в рану.
А. К. Каюми (1980) изучал влияние препаратов меди на заживление гнойных ран мягких тканей. Он выявил, что препараты показаны в фазе гидратации при развитии гнойных ран мягких тканей, особенно при наличии полирезистентной микрофлоры. По мнению автора, наибольшим бактерицидным эффектом и наименьшим повреждающим действием обладает сухой порошок или 5% раствор меди сульфата при однократном его применении. Также рекомендуется применение кристаллического сульфата меди и натрия тетрабората в равных весовых частях. В клинике для лечения гнойных ран мягких тканей челюстно-лицевой области использовали 5% раствор и сухой порошок меди сульфата. После вскрытия гнойного очага или разведения краев нагноившейся раны образовавшуюся полость промывают раствором перекиси водорода в целях максимального удаления гнойного содержимого, а затем изотоническим раствором натрия хлорида - для удаления остатков перекиси водорода. На раневую поверхность тонким слоем наносят препарат меди, а в глубокие раны препарат вводят с помощью марлевых тампонов, смоченных 5% раствором сульфата меди. Перевязку раны проводят через 24 ч. При этом отмечается легкий специфический запах препарата, исчезает гнилостный запах, а стенки и дно раневой поверхности окрашиваются в синевато- бурый цвет. Для удаления препарата полость раны повторно обрабатывают физиологическим раствором натрия хлорида. Применение препарата не оказывает отрицательного влияния на ткани, стимулирует образование грануляционного вала и приток полиморфноядерных лейкоцитов с высокой окислительно-восстановительной активностью ферментов, ускоряет очищение раны и ее заживление.
Выраженными антимикробными свойствами обладают соединения йода в комплексе с растворителями и носителями (йодофоры). Для лечения гнойных ран используют йодинол. Его применяют в виде аппликаций и для промывания гнойных полостей. Установлено, что йодинол оказывает бактерицидное действие на стрептококк, кишечную палочку и стафилококк (С.М. Курбангалеев,1985). Синегнойная палочка оказывается устойчивой к местному применению йодинола. В случае появления в раневом отделяемом палочки сине-зеленого гноя к растворам, которыми пропитывают повязки, рекомендуют добавлять порошок борной кислоты в соотношении 1:10 на фоне перорального или парентерального введения полимиксина (Ю.Г. Шапошников, Е.А. Решетников, 1984) или применять смесь равных количеств солафура и борной кислоты (М.И. Лыткин, 1977).
Широкое применение в лечении гнойных ран получили протеолитические ферменты, что обусловлено их некролитическим и противоотечным действием. В качестве протеолитических ферментов применяются: трипсин, химотрипсин, химопсин, террилитин и др. Местное применение этих препаратов обеспечивает более быстрое и безболезненное очищение раны, оказывает противовоспалительное и противоотечное действие. Расщепляя белки некротизированных тканей, протеолитические ферменты лишают микроорганизмы субстрата для питания и размножения, повышая их чувствительность к воздействию антибактериальных препаратов. К недостаткам всех протеаз при их местном применении следует отнести отсутствие лизирующего действия на коллаген. При их применении невозможно добиться полного очищения ран. Другим недостатком этих препаратов является кратковременность их действия: они инактивируются через 15-30 мин (К.Н. Веременко, 1967; М.Ф. Камаев, 1980). Цитологические исследования, проведенные во время лечения гнойных ран, показали, что протеолитические ферменты нормализуют количество нейтрофильных гранулоцитов в ране и повышают их функциональную активность, сокращая сроки очищения гнойных полостей от некротизированных тканей, вызывают более быстрое появление грануляций и эпителизацию раны. Для ферментативного очищения гнойных ран с успехом применяется препарат ируксол, содержащий коллагеназу. Он активно лизирует некротические ткани и одновременно повреждает раневой коагулят - биологический барьер на пути проникновения бактерий в кровеносные и лимфатические пути (В.К. Сологуб и соавт., 1978: М.А. Трунин, С.А. Емельянов, 1982; X. Шарма, 1978).
Среди других химиопрепаратов следует отметить диметилсульфоксид (димексид, ДМСО). Он обладает бактерицидным, противовоспалительным, гипосенсибилизирующим, болеутоляющим свой-ствами. Важной особенностью диметилсульфоксида является способность транспортировать другие лекарственные вещества, что потенцирует их действие. Димексид был применен при местном лечении гнойных ран и под повязкой. Использовался 30% раствор диметилсульфоксида с антибиотиками широкого спектра действия, хлорофиллиптом и новокаином. Лучшие результаты были получены при лечении ран после купирования избыточной экссудации. Применение этой смеси препаратов позволило сократить сроки заживления ран. Лишь у некоторых больных была отмечена аллергическая реакция на препарат. Л.И. Коломиец (1984) использует диметилсульфоксид в комплексном лечении больных острым периоститом, перикоронитом и альвеолитом.
В последние годы с успехом применяются некоторые поверхностно-активные вещества - 0,5-1% раствор диоксидина или 0,1-0,2% раствор хпоргексидина.
Местно применяют 0,5-1% растворы диоксидина. Для получения 0,5% раствора ампульные растворы препарата разводят до нужной концентрации стерильным изотоническим раствором хлорида натрия или водой для инъекций.
Для лечения поверхностных инфицированных гнойных ран после обычного туалета на рану накладывают салфетки, смоченные 0,5-1% раствором диоксидина; сверху кладут несколько сухих салфеток (при необходимости между сухими салфетками и смоченным диоксидином, можно положить прокладку из компрессной бумаги). Повязки меняют ежедневно или через день, в зависимости от количества отделяемого раны. Глубокие гнойные раны после промывания общепринятыми методами рыхло тампонируют тампонами, смоченными 1% раствором диоксидина, а при наличии дренажной трубки в полость вводят от 20 до 100 мл 0,5% раствора препарата. Перевязки делают один раз в сутки. Можно рекомендовать повторное смачивание тампонов в ране раствором диоксидина, не вынимая тампона из раны.
Растворы препарата в концентрации 0,5-1% применяют в виде ванночек для лечения глубоких гнойных ран при остеомиелите или проводят специальную обработку раны раствором препарата в течение 15-20 минут (введение в рану раствора на этот срок) с последующим наложением повязок с 1 % раствором диоксидина.
После стихания воспалительных процессов в ране, очищения ее от гнойно-некротических и фибринозных масс, появления грануляций и эпителизации, то есть на стадии регенерации, местно следует применять средства, стимулирующие регенеративные процессы. Для стимуляции регенерации тканей используют препараты, содержащие витамины (каротолин), гиалуроновую кислоту (луронит), хондроитинсерную кислоту (хонсурид) и др.
Разработаны биологически активные перевязочные материалы, которые представляют собой новые формы повязок для ран, в которых сочетаются неспецифические сорбционные свойства углеволокнистой основы и специфическое локальное действие введенных в нее биологически активных добавок.
Модифицированные повязки предназначены для местного лечения ран различной этиологии в последовательных фазах раневого процесса и одновременной детоксикации организма через открытые повреждения.
Новые перевязочные материалы продемонстрировали абсолютную безвредность для организма, высокую биосовместимость. В эксперименте и клинике показана эффективность модифицированных повязок, как средств локального воздействия на рану и общей детоксикации организма.
Комплексное применение модифицированных перевязочных материалов, ориентированных на отдельные фазы раневого процесса, особенность заживления ран и характер осложнений, позволяет существенно улучшить результаты лечения, сократить сроки подготовки ран к закрытию, при значительно меньшем объеме перевязок предупредить развитие осложнений и, в конечном счете, ускорить выздоровление.
Сферичный угольный сорбент - это гранулы черного цвета, блестящие, сферической формы, нерастворимые с многочисленными порами.
Н.Н. Воляк (1994) рекомендует для максимального использования сорбционных свойств препарата изготавливать мешочки разных размеров и формы, заполняя их сорбентом. Мешочки делают из синтетических фильтров одноразовых систем для внутривенного введения или стерильной марли. Изготовленные из этих мешочков устройства автор предлагает использовать в качестве дренажей. Замена их проводится в первые два дня 2 раза в сутки, в последующие - 1 раз в сутки до очищения гнойной раны (Воляк Н.Н., 1994).
В последние годы находят применение диспергированные волокнистые углеродные сорбенты (ДВУС) в 70% этиловом спирте или 0,2% растворе сульфата цинка.
ДВУС рекомендуется для лечения небольших по размеру гнойных ран и поверхностных ожогов, мокнущих трофических язв, а также эрозивных поражений слизистых полостей носа, рта.
ДВУС относится к группе перевязочных средств, обладающих высокой сорбционной активностью по отношению к низко-, средне- и высокомолекулярным физиологически активным веществам, включая продукты белкового катаболизма и протеолиза, бактериальные токсины и микробные тела. Удаляя медиаторы воспаления, на ранней стадии развития раневого процесса ДВУС снижает интенсивность местной воспалительной реакции и купирует травматический отек.
Гемостатические свойства углеволокнистого сорбента позволяют в 4,5 раза сократить время капиллярного кровотечения. ДВУС успешно предотвращает вторичное инфицирование и способствует быстрому заживанию ран при отсутствии местных осложнений. Измельчение углеволокнистого сорбента до отдельных волокон (длиной 3-5 мм) увеличивает его активную поверхность, улучшая тем самым его сорбционно - кинетические свойства: а также позволяет осуществлять более полный контакт с поверхностью ран самой сложной конфигурации при существенном сокращении расхода сорбента на одну перевязку. Входящие в состав ДВУС наполнители (спирт или сульфат цинка) оказывают дополнительный антибактериальный или противовоспалительный эффект.
Повязка сорбирующая бактерицидная представляет собой активированную углеродную ткань с односторонним ультратонким медным покрытием. Предназначена для лечения инфицированных ран и ожогов. Входящая в состав повязки медь обусловливает выраженный бактерицидный эффект по отношению как грамположительной, так и грамотрицательной микрофлоре, а высокоемкостная углесорбционная матрица обеспечивает сорбцию высокомолекулярных эндотоксинов в количествах не ниже 2,2 мг/г сорбента. После вскрытия пакета повязка увлажняется (вода, 0,9% раствор хлорида натрия, раствор фурацилина и пр.) и накладывается на рану покрытой медью стороной. Смена повязки производится через 8-12 часов.
Двухслойная коллагенсодержащая углеродная повязка — сорбирующая, гемостатическая, предназначена для обработки свежих хирургических и травматических ран с целью быстрой остановки кровотечения и предупреждения массивной кровопотери, а также удаления из поврежденных тканей гистиогенных токсинов, инициирующих развитие травматического отека и аутотоксемии. После вскрытия двойного пакета гемостатическую повязку накладывают углеродным слоем на свежую травматическую рану на 30-60 мин. Затем повязку удаляют, рану подвергают хирургической обработке, после чего закрывают раневую поверхность сорбирующей или бактерицидной повязкой.
Повязка сорбирующая некролитическая представляет собой активированную углеродную ткань с иммобилизированным комплексом микробных протеаз. Обладает экзо- и эндо-пептидазной активностью. Предназначена для лечения гнойных ран, трофических язв и гнойно-воспалительных заболеваний путем ферментативного лизиса раневого детрита с последующим поглощением продуктов протеолиза высокоактивной углеродной матрицей. После вскрытия пакета повязка обильно смачивается (вода, 0,9% раствор хлорида натрия, раствор фурацилина и пр.) и накладывается на раневую поверхность. Смена повязки производится не реже одного раза в сутки. В период между перевязками повязка должна оставаться влажной.
Повязка гигроскопическая репаративная - это трехслойная биологически активная повязка предназначена для местного лечения гнойных, вялотекущих гранулирующих ран, трофических язв, ран с обильным экссудатом, глубоких и обширных ожогов. Терапевтический эффект достигается за счет сочетания дренирующих свойств внешнего слоя, высокой сорбционной активности углеволокнистого внутреннего слоя и стимуляции регенеративно-репаративных процессов в ране под действием продуктов биодеградации промежуточного слоя повязки. После вскрытия пакета повязка слегка увлажняется (вода, 0,9% раствор хлорида натрия, раствор фурацилина и пр.) и накладывается углеродным слоем на раневую поверхность. Смена повязки производится через 12-48 часов по показаниям.
Актовегин - это депротеинизированный гемодериват из телячьей крови с низкомолекулярными пептидами и дериватами нуклеиновой кислоты. Актовегин используется для лечения открытых ран и для начального очищения ран с язвами, для стимулирования грануляции и для мокнущих поражений, способствует более быстрому образованию эпителия немокнущих ран и язв при последующем лечении. У пациентов с повышенной чувствительностью наблюдаются аллергические реакции (например, крапивница, внезапное покраснение, лекарственная лихорадка). В таких случаях необходимо прекратить лечение.
2. Антибактериальная терапия
При развитии гнойно-воспалительных заболеваний и гнойно-септических осложнений у больных с челюстно-лицевой патологией необходимо назначать антибактериальные препараты, подавляющие бурное размножение и патогенные свойства микроорганизмов и их ассоциаций. Добиться снижения развития гнойно-воспалительных и гнойно-септических заболеваний можно двумя способами: воздействием на микрофлору при помощи бактерицидных и бактериостатических препаратов или путем усиления иммунозащитных свойств организма больного.
С момента широкого внедрения в клинику антибиотиков первый путь получил большое распространение. С тех пор антибиотики прочно заняли самостоятельное место в группе химиотерапевтических средств.
Однако широкое применение антибиотиков на современном этапе имеет ряд недостатков. Это касается, прежде всего, повышения резистентности некоторых вирулентных микроорганизмов к антибиотикам. Появляются новые стойкие штаммы микроорганизмов. Установлено, что во многих случаях антибиотики оказываются недейственными в связи с возрастающей устойчивостью к ним микроорганизмов, они способствуют росту этиологической роли условно-патогенной микрофлоры. Антибиотики сами стали причиной развития ряда осложнений - интоксикаций, аллергических реакций, дисбактериоза и др. В настоящее время антибиотикотерапию нужно рассматривать, как составную часть комплексного лечения острых одонтогенных воспалительных заболеваний.
Основными противомикробными препаратами, которые применяются для лечения острой одонтогенной инфекции, являются: антибиотики, сульфаниламиды и препараты нитрофуранового ряда. После проведенного хирургического вмешательства лечение дополняется внутримышечным или внутривенным, в зависимости от тяжести течения заболевания, введением антибиотиков. Обычно до получения результатов посева на микрофлору и определения ее чувствительности к химиопрепаратам назначаются антибиотики широкого спектра действия
Назначая больному химиотерапевтический препарат, необходимо учитывать спектр его антимикробного действия. Доза антибиотика подбирается индивидуально и зависит от возраста, тяжести течения процесса, чувствительности микрофлоры, состояния выделительной функции почек и печени, переносимости препарата больным.
Курс лечения антибиотиками часто начинают с назначения “ударных” доз препарата. Но, по мнению А.Б. Черномордина (1984 г.) применение повышенных доз в начале лечения может привести к реакции обострения вследствие выделения большого количества микробных эндотоксинов в результате быстрого разрушения большого количества их клеток. Другой отрицательной стороной является развитие аллергии, наслоение токсических осложнений, дисбактериоза, кандидоза.
Отмечено также, что назначение малых доз приводит к недостаточному лечебному эффекту и рецидивам заболевания, а также облегчает развитие у патогенных бактерий лекарственной устойчивости в результате выживания менее чувствительных к препарату особей с последующей их селекцией и размножением.
Особое внимание уделяется антибиотикам, обладающим тропизмом к костной ткани. Линкомицина гидрохлорид назначают по 0,6 г./сут., а при тяжелом течении процесса - каждые 8 часов. При выявлении возбудителя назначение препаратов проводят по данным антибиотикограммы с учетом чувствительности микроорганизма и совместимости парных сочетаний антибиотиков.
Курс антибиотикотерапии следует проводить не менее 7-8 сут. При длительном применении антибиотиков их нужно менять каждые 10 дней (согласно антибиотикограмме) для того, чтобы не выработать устойчивости микроорганизмов к препарату и избежать его побочных действий. Появление различного рода осложнений служит основанием для замены препарата. Всем больным следует еженедельно делать развернутый анализ крови, причем следует обращать внимание на изменения числа лейкоцитов и отдельных видов клеток белой крови. Длительное применение антибиотиков широкого спектра действия следует сочетать с назначением противогрибковых препаратов (нистатин по 500.000 ЕД 3-4 раза в сут.; леворин по 500.000 ЕД 2-4 раза в сут.; гризеофульвин 0,5 г. 4 рза в сут.)
Врач, на основании клинических признаков и изучения патогенеза заболевания, должен своевременно диагносцировать наличие у больного анаэробной инфекции. При этом необходимо правильно организовать забор и доставку исследуемого материала в микробиологическую лабораторию. Антибиотикотерапию следует назначать до получения результатов лабораторных исследований. Как правило, в развитии анаэробной инфекции принимают участие 3-5 штаммов микроорганизмов и поэтому лечение должно быть комплексным и направленным против всех патогенетических факторов. (Высокой активностью против неспорогенных анаэробов обладает метронидазол (трихопол) по 250-750 мг./ 3 р. в сут.)
Аэробная инфекция, присутствующая в микробных ассоциациях, поглощая кислород, поглощая кислород, создает благоприятные условия для развития бактероидной инфекции. Этот фактор также является показанием к назначению метронидазола. (Однако, его не следует назначать беременным, особенно в ранние сроки, т.к. он проникает через плацентарный барьер.) Метронидазол также обладает способностью вызывать сенсибилизацию к спиртным напиткам (М.Д. Машковский, 1994).
Применение антибиотиков целесообразно сочетать с применением сульфаниламидов и препаратами нитрофуранового ряда. Сульфаниламиды инактивируют бета-лактомазу и тем самым позволяют преодолеть устойчивость микробных возбудителей к пенициллину. Некоторые виды бактероидов вырабатывают бета-лактомазу, снижающую концентрацию соответствующих антибиотиков в окружающих тканях, что способствует защите и тех микроорганизмов, которые находятся в ассоциации с бактероидами в очаге поражения, хотя в виде чистых культур эти бактерии являются чувствительными к соответствующим препаратам.
Комбинированным препаратом с активным бактерицидным действием является бактрим (бисептол), включающий сульфаниламидный препарат сульфаметоксазол и производное диа-минопиридина - триметоприм. Благодаря этому на метаболизм бактерий оказывается двойное блокирующее действие. При приеме внутрь препарат быстро всасывается и создает в организме высокие концентрации, которые сохраняются в течение 7 ч.
В комплексном лечении гнойно- воспалительных заболеваний челюстно-лицевой области находят широкое применение сульфаниламиды пролонгированного действия (сульфадиметоксин, сульфален, сульфапиридазин). Необходимо помнить, что применение антибиотиков и сульфаниламидных препаратов способствует снижению содержания в организме аскорбиновой кислоты и витаминов группы В. Между тем известно, что недостаток в организме аскорбиновой кислоты резко ухудшает течение воспалительного процесса.
Известно, что терапевтические дозы лекарств, применяемых для лечения гнойно-воспалительных процессов у детей в зависимости от возраста ребенка меняются. Государственная фармакопея рекомендует рассчитывать дозу лекарств для детей исходя из их возраста. При этом дозу лекарственного вещества для взрослого принимают за единицу. Ребенку дается определенная часть дозы взрослого.
• Ребенку до одного года назначают 1/24 -1/12 дозы взрослого, в один год - 1/12,
• в 2 года-1/8, в 4 года - 1/6, в 6 лет-1/4, в 7 лет-1/3, в 14 лет-1/2,
• в 15-16 лет - 3/4 дозы взрослого.
Существует схема расчета доз лекарств для детей с учетом массы тела ребенка, изменения физиологических функций, а также переносимости детьми тех или иных препаратов:
К = 2 х возраст (лет) + масса тела,
где К - % от дозы взрослого для ребенка определенного возраста и соответствующей массы тела. Например, для 4-летнего ребенка с массой тела 20 кг доза лекарств составит:
2 х 4 + 20 = 28 (28% дозы взрослого).
Уровень концентрации антибиотиков в крови лиц пожилого и старческого возраста, особенно при более или менее продолжительном применении, выше, чем у молодых, что связано с замедлением выделения этих веществ почками. Аминогликозиды, макролиды, тетрациклины и цефалоспорины можно применять только при отсутствии почечной недостаточности. В гериатрической практике необходимо учитывать возможность ототоксического действия некоторых антибиотиков (стрептомицина, гентамицина, неомицина и др.) на функцию слуховых нервов, а также их способность вызывать развитие кандидоза, атрофического глоссита и дефицита витаминов группы В. При лечении лиц пожилого и старческого возраста с антибактериальными препаратами одновременно следует назначать противогрибковые препараты и поливитамины.
Антибактериальной активностью обладает такое сложное органическое соединение, как хлорофиллипт - препарат, содержащий смесь хлорофиллов, находящихся в листьях эвкалипта. Препарат активен в отношении антибиотикоустойчивых стафилококков, его можно применять во внутрь, внутривенно, местно. Внутрь применяют по 25 капель 1% спиртового раствора хлорофиллипта ежедневно 3 раза в сутки за 40 мин до еды. Внутривенно препарат вводят при сепсисе. Для этого 2 мл 0,25% спиртового раствора хлорофиллипта разводят 38 мл стерильного изотонического раствора натрия хлорида (то есть в 20 раз). Раствор готовят перед употреблением и вводят внутривенно по 40 мл 4 раза в сутки ежедневно в течение 4-5 дней. При местном применении 1% спиртовой раствор разводят 1:5 в 0,25% растворе новокаина. Независимо от избранного способа применения препарата вначале определяют чувствительность к нему. С этой целью больному дают 25 капель препарата, растворенного в одной столовой ложке воды. При отсутствии через 6-8 ч признаков аллергии (отечность губ, слизистой зева и др.) хлорофиллипт можно применять.
Исследования, проведенные В.С. Стародубцевым и соавторами (1983). свидетельствуют об изменении содержания калия и натрия в сыворотке, эритроцитах крови, а также в моче у больных с острыми воспалительными процессами. У больных тяжелым и средней тяжести течением воспалительных заболеваний коррекцию электролитного баланса целесообразно проводить не только в послеоперационный, но и в предоперационный период.
3. Десенсибилизирующая терапия
Для улучшения микроциркуляции в тканях и "вымывания" в кровяное русло бактерий, токсинов и продуктов распада назначают растворы, содержащие декстран, как средства детоксикации (полиглюкин, реополиглюкин, реоглюман, рондекс, реомакродекс). При введении в ток крови они усиливают процессы перемещения жидкости из ткани в кровяное русло, что способствует процессу детоксикации.
Полиглюкин - 6% раствор среднемолекулярной фракции частично гидролизованного декстрана в изотоническом растворе натрия хлорида Вследствие высокого осмотического давления, превышающего примерно в 2,5 раза осмотическое давление белков плазмы крови, полиглюкин удерживает жидкость в кровяном русле, оказывая таким образом гемодинамическое действие. Препарат вводят внутривенно, обычно используют 400-500 мл на одно вливание. При вливании полиглюкина следует после первых 10 и последующих 30 капель сделать перерыв на 3 минуты. Если отсутствует реакция, то трансфузию продолжают. В случае появления жалоб на чувство стеснения в груди, затрудненное дыхание, боли в пояснице, а также при наступлении озноба, цианоза, нарушении кровообращения трансфузию полиглюкина прекращают, внутривенно вводят 20 мл 40% раствора глюкозы, сердечные средства, а также противогистаминные препараты. Противопоказания для введения полиглюкина: травмы черепа с повышением внутричерепного давления, кровоизлияния в мозг, заболевания почек (с анурией), сердечная недостаточность и другие жидкости, когда нельзя вводить большое количество жидкости.
Реополиглюкин - 10% раствор декстрана. Способствует восстановлению кровотока в капиллярах, оказывает дезинтоксикационное действие, предупреждает и уменьшает агрегацию форменных элементов крови. Реополиглюкин, как и полиглюкин, выводится из организма, в основном, почками. В первые сутки выводится около 70%. При сниженной фильтрационной способности почек или при необходимости ограничения введения натрия хлорида назначают реополиглюкин с глюкозой.
Реоглюман - 10% раствор декстрана с добавлением 5% маннита и 0,9% натрия хлорида в воде для инъекций. Вводят реоглюман внутривенно капельно. Начинают с введения 5-10 капель в минуту в течение 10-15 минут, после введения 5-10 капель, а затем 30 капель делают перерывы на 2-3 минуты. Если нет нежелательных реакций, переходят на введение препарата со скоростью 40 капель в минуту
Рондекс - 6% раствор декстрана в 0,9% растворе натрия хлорида. По показаниям к применению, дозам и противопоказаниям сходен с полиглюкином.
Реомакродекс - зарубежный препарат, близкий к полиглкжину и его аналогам. Представляет собой раствор, содержащий 10% декстрана в изотоническом растворе натрия хлорида. Оказывает гемодинамическое, дезинтоксикационное и противоагрегационное действие.
Для дезинтоксикации используют растворы "дисоль”, “трисоль", "ацесоль", "хлосоль". "квартасоль", "квартасол". "санасол" и др.
Кроме реополиглюкина и полиглюкина желательно вводить 5-10% растворы глюкозы в количестве 500-1000 мл с инсулином (1 ЕД инсулина на 5 граммов глюкозы), которая обладает дезинтоксикационным действием и является дополнительным источником энергии. Ее введение следует сочетать с внутривенным введением изотонических жидкостей (изотонический раствор натрия хлорида - 500 мл, 5% раствор гидрокарбоната натрия - 200-300 мл и др.). Внутривенное введение кровезаменителей необходимо сочетать с назначением ингибиторов протеиназ (контрикал), антибиотиков широкого спектра действия (пентрексил, кефзол, цефаме-зин и др.), аскорбиновой кислоты и витаминов группы В, гипосенсибилизирующих и жаропонижающих препаратов.
Проводя дезинтоксикационную терапию, следует учитывать возможность повышения токсичности крови при введении полиглюкина и аналогов, так как улучшение микроциркуляции приводит к вымыванию токсических продуктов из тканей и накоплению их в крови. Поэтому показано последующее введение гемодеза. В основе механизма дезинтоксицирующего действия препарата лежит способность связывать токсины только из циркулирующей крови и быстро выводить их через почки. Это возможно благодаря его свойству усиливать почечный кровоток, быстро проходить через почечный барьер, повышать клубочковую фильтрацию и увеличивать диурез. Введение гемодеза осложнений не вызывает. При повышении скорости вливания (более 60 капель в 1 мин) может наблюдаться падение артериального давления. В этих случаях прибегают к введению сосудосуживающих и сердечных средств. Вводят гемодез по 200-400 мл со скоростью 40-60 капель в 1 мин. Повторное его введение проводят через 10-12 ч. Его однократное введение позволяет снизить токсичность крови в 1,5-2 раза. Подобный эффект удерживается в течение 10-12 ч, после чего рекомендуется повторное введение препарата. Гемодез следует вводить после средств, улучшающих микроциркуляцию.
Важным моментом детоксикации при тяжелых гнойно-воспалительных заболеваниях лица и шеи является форсированный диурез. Он основан на использовании естественного процесса удаления токсических веществ из организма почками благодаря их концентрационно-выделительной функции. Больной получает 3000-4000 мл жидкости и выделяет 3000-4000 мл мочи. Проводится почасовый учет количества введенной жидкости и выделенной мочи. В целях проведения форсированного диуреза вводят маннит - 1-1,5 кг/массы тела больного - или лазикс - 40-80 мг. Действие последнего потенцируется 24% раствором эуфиллина (вводится 10 мл эу-филлина в 20 мл 20% раствора глюкозы).
Больным с выраженной гиповолемией рекомендуется назначение белковых препаратов крови: 10-20% раствор альбумина (200 мл), протеин (250 мл) или плазму (200-300 мл). Они оказывают стимулирующее действие на выделительную, нейроэндокринную и гемопоэтическую функции организма, а также способность выводить из организма токсические продукты.
В последние годы находит применение гемосорбция - метод выведения токсинов из организма путем экстракорпоральной перфузии крови через гранулированные или пластинчатые сорбенты. Данный метод был использован у тяжелых больных острыми гнойно-воспалительными процессами лица и шеи. Получен положительный эффект.
В последние годы нашел применение метод квантовой гемотерапии. Сущность его заключается в инфузии малых доз собственной крови больного, предварительно подвергшейся ультрафиолетовому облучению. Эффективность его обусловлена тем, что малые дозы УФ- облученной крови приобретают бактерицидные свойства и способны инактивировать токсины, они повышают неспецифическую резистентность организма больного (В.И. Карандашов и соавт., 1982). Отмечен положительный эффект данного метода лечения у больных флегмоной челюстно-лицевой области, в профилактике сепсиса и лечении септического шока (В.И. Карандашов, Е.Б. Петухов, 1983,1984).
4. Иммунотерапия
В последние годы нам все чаще приходится встречаться с воспалительными заболеваниями челюстно-лицевой области и шеи у больных с нарушением факторов специфической и неспецифической резистентности организма (Л.М. Цепов, 1981; В.С. Дмитриева и соавт.,1983, М.А. Губин,1984; Я.М. Биберман, 1985; А.М. Солнцев, А.А. Тимофеев, 1986; А.А. Тимофеев, 1995). В связи с этим целесообразно включать в комплексное лечение такие препараты, которые повышают в организме пассивный или активный иммунитет. Следует отметить, что иммуностимуляторы подразделяют на препараты, повышающие пассивный и активный иммунитет. Они способны повышать резистентность организма в 1-е же часы после инъекции препарата, но она сохраняется лишь непродолжительное время (несколько дней), а затем постепенно снижается. Пассивный иммунитет повышают иммунные сыворотки и другие препараты, изготавливаемые из крови иммунизированных людей. Лечебное действие препаратов основывается на наличии в них готовых антител. Однако из-за быстрого выделения или разрушения введенных антител лечебное действие данных средств весьма короткое, что требует их повторного введения через 2-4 дня. Пассивные иммуностимуляторы применяют только при тяжелом течении острых воспалительных процессов, которые развиваются у ослабленных людей.
Гипериммунная антистафилококковая плазма является высокоактивным средством пассивной иммунизации и применяется в комплексном лечении тяжелых гнойно- воспалительных процессов, вызванных стафилококком. Препарат обладает синергизмом с антибиотиками. Титр противостафилококковых антитоксинов в плазме должен быть не менее 5 МЕ в 1 мл. Вводят ее внутривенно из расчета 4-6 мл на 1 кг массы тела больного 1 раз в сутки с интервалом 1-2 суток. Курс лечения состоит из 3-6 введений препарата в зависимости от тяжести течения процесса и терапевтического эффекта. Антистафилококковую плазму можно применять в виде тампонов, турунд и повязок, которые накладываются на гнойные раны.
Из антистафилококковой плазмы получают антистафилококковый иммуноглобулин, в котором сконцентрированы (в 3-10 раз больше) антитела исходной плазмы. При этом обеспечивается концентрация в основном иммуноглобулина С, который содержит основную массу антитоксических антител (противостафилококковых). Препараты вводят детям до 1 года по 1 мл ежесуточно или через сутки (на курс лечения 8-10 введений), а детям старше одного года - по 2-4 мл. Взрослым вводят по 3-5 мл препарата ежедневно или через день до получения клинического эффекта.
Под влиянием специфической антистафилококковой иммунотерапии наступает Дезинтоксикация, инактивируется стафилококковый токсин, который играет роль антигена. Это, в свою очередь, приводит к гипосенсибилизации и восстановлению иммунологической реактивности организма больного (Е.А. Федоровская, 1979).
К веществам, вызывающим активный иммунитет, относятся анатоксины, различные вакцины (препараты из убитых бактерий-возбудителей) и аутовакцины. Иммунитет после введения вакцинных препаратов развивается постепенно, а для его усиления необходимы повторные введения. Полностью активный иммунитет образуется только после проведения полного курса вакцинации, но не сразу, а через несколько недель и продолжается длительно (А.Б. Черномордик,1986). Средства активной иммунизации вводятся при остеомиелитах, гнойных лимфаденитах, абсцессах, флегмонах и др.
Стафилококковый анатоксин (адсорбированный) вводится подкожно по схеме: 0,5-0,5-1,0 мл с интервалом между введениями 5-7 суток. Стафилококковую лечебную вакцину (антифагин стафилококковый) вводят подкожно в область плеча или нижнего угла лопатки. Курс лечения для взрослых и детей школьного возраста состоит из ежедневных инъекций по схеме: 0,2-0,3-0,4-0,5-0,6-0,7-0,8-0,9-1,0 мл. Детям до 7 лет первую инъекцию делают в объеме 0,1 мл. При отсутствии реакции в дальнейшем препарат вводят по указанной схеме.
Бактериофаг представляет собой фильтрат фаголизата определенных бактерий, обладающих способностью специфически лизировать соответствующие виды патогенных микробов. Применяют стафилококковый, стрептококковый, протейный, анаэробный бактериофаги, колифаг (растворяющий кишечную палочку), пиоцианеус бактериофаг (растворяющий сине-гнойную палочку). Бактериофаги мы применяем, в основном, местно, так как остатки растворенных бактерий и белки среды при парентеральном введении могут вызвать нежелательные реакции. Бактериофаги применяют в количестве от 5 до 20 мл в виде орошения ран или на тампонах, в зависимости от размеров гнойной раны. Применение стафилококкового антифагина и бактериофагов при лечении одонтогенных гнойных лимфаденитов, абсцессов и флегмон позволило нам значительно ускорить очищение раны (А.М. Солнцев, А.А. Тимофеев, 1986).
При проведении иммунотерапии с помощью аутовакцины можно использовать инактивированную микробную взвесь с концентрацией 1 млрд. микробных тел в 1 мл, выделенную у больного. Препарат изготавливается в местной бактериологической лаборатории. Первая инъекция аутовакцины производится внутрикожно в дозе 0,2 мл (для выяснения степени местной реакции). С каждой последующей инъекцией дозу увеличивают на 0,2 мл. Препарат вводят подкожно через 2-3 дня. Курс лечения состоит из 15-20 введений аутовакцины.
Для повышения неспецифической резистентности организма применяются биостимуляторы. В последние годы внимание клиницистов привлекает отечественный препарат тималин, который получен из вилочковой железы В.Г. Морозовым и В.Х. Хавинсоном (1974). Тималин вводят ежедневно внутримышечно по 10-20 мг в 2 мл 0,25% раствора новокаина утром и вечером в течение 5-12 суток. Результаты исследований показали, что тималин обладает не только стимулирующим действием, но и нормализует клеточный иммунитет, повышает эффективность проводимого лечения (В.А. Козлов и соавт., 1981; М.М. Соловьев и соавт., 1981, 1984).
Продигиозан - неспецифический стимулятор полисахаридной природы. Применяется в дозе 2 мл (50 мкг) внутримышечно 2 раза в неделю.
Для повышения неспецифической резистентности организма наиболее часто используют производные пиримидина (метилурацил, пентоксил). Препараты способствуют выработке специфических антител, повышают активность системы мононуклеарных фагоцитов и оказывают некоторое противовоспалительное действие. Мы назначаем метилурацил взрослым в дозе 0,5 г 3-4 раза в сутки во время или после еды в течение 2 недель, а пентоксил - по 0,2-0,4 г 3-4 раза в сутки после еды. Пентоксил и метилурацил - ускоряют рост и деление клеток, выработку антител, ускоряют регенераторную способность тканей, повышают фагоцитарную активность макро- и микрофагов. Эти препараты широко используют у лиц пожилого и старческого возраста (Ю.Ф. Григорчук, О.В. Рыбалов, 1976, 1980 гг.).
Как биостимулятор можно применять нуклеинат натрия, который практически нетоксичен. Назначают его внутримышечно по 5-10 мл 2-5% раствора или внутрь по 0,1-0,2 г 3-4 раза в сутки. Курс лечения -10-15 суток. По нашему мнению, нуклеинат натрия более эффективен при назначении его в виде внутримышечных инъекций и в сочетании с лизоцимом (А.А. Тимофеев, 1986,1988).
В качестве биостимулятора используется левамизол (декарис). Препарат повышает фагоцитарную активность лейкоцитов и макрофагов, вызывает восстановление в крови содержания Т- лимфоцитов. Если их содержание в крови близко к норме, то левамизол не оказывает на них никакого влияния. На содержание иммуноглобулинов (В- лимфоцитов) декарис не влияет (В.П. Зуев, 1983; Т.Г. Робустова и соавт., 1984). Препарат вводят внутрь по 150 мг. При его применении, особенно повторном, могут наблюдаться изменения вкусовых ощущений, обонятельные галлюцинации и аллергические реакции (А.Б. Черномордик, 1986). Оптимальные дозы левамизола и методы его применения, включая интервалы между приемами, до настоящего времени окончательно не установлены.
Биологически активным препаратом является лизоцим (фермент белковой природы), который вводится в виде внутримышечных инъекций по 100-150 мг 2 раза в день в течение 5-7 дней. Местно препарат применяется в виде 0,5% раствора. Оказывает бактериолитическое действие. Обладает способностью разрушать полисахариды микробной оболочки. Препарат нетоксичен, не раздражает тканей и применяется при плохой переносимости других антибактериальных препаратов. Острые гнойно- воспалительные заболевания мягких тканей протекают на фоне временного иммунодефицита - снижения содержания лизоцима в крови, смешанной слюне и слюне, полученной при катетеризации больших слюнных желез. Поэтому назначение лизоцима применяется как патогенетическое лечение. Повышая местный неспецифический иммунитет тканей челюстно-лицевой области и шеи, сокращаются сроки лечения больных гнойными лимфаденитами, абсцессами и флегмонами на 3-6 дней. Антимикробный эффект препарата позволил отказаться от назначения антибиотиков у больных с острыми серозными и гнойными лимфаденитами, а также одонтогенными абсцессами. При флегмонах рекомендуется сочетать применение лизоцима и антибиотиков, которые обладают синергизмом и увеличивают эффективность проводимого лечения (А.А. Тимофеев, 1988).
Для усиления активности химиотерапии применяют препараты алоэ, ФИБС, сок каланхоэ
и др. Сходное действие оказывают витаминные препараты группы В, аскорбиновая кислота,
поливитамины, пивные дрожжи.
Большое влияние на состояние иммунологической резистентности организма оказывает аллергизация. Высокая степень аллергизации больного снижает защитные реакции его организма, способствует более тяжелому течению гнойно- воспалительного процесса и рецидивам заболевания. К средствам неспецифической гипосенсибилизирующей терапии следует отнести димедрол (по 0,03-0,05 г 1-3 раза в сутки), дипразин (по 0,025 г 2-3 раза в сутки), диазолин (по 0,1 г 2-3 раза в сутки), супрастин (по 0,025 г3-4 раза в сутки), тавегил (по 0,01 г 2-3 раза в сутки). Установление взаимосвязи возникновения и течения острых одонтогенных воспалительных заболеваний мягких тканей и челюстей с наличием микробной сенсибилизации указывает на необходимость проведения также и специфической микробной гипосенсибилизации как патогенетического звена в комплексном лечении этих больных (А.А. Тимофеев, 1981,1982; А.М. Солнцев, А.А. Тимофеев, 1984). Показанием к проведению специфической микробной гипосенсибилизации является: кожнореактивный тест (кожные пробы) +++ и повышение показателя повреждения нейтрофильных гранулоцитов крови более 0,25. Для специфической гипосенсибилизирующей терапии применяются микробные аллергены, которые используются для кожных проб. Для специфической гипосенсибилизирующей терапии применяют стафилококковый антифагин.
5. Общеукрепляющая терапия
Как общеукрепляющее средство находит широкое применение экстракт элеутерококка (по 30 капель 3 раза в сутки за полчаса до еды) или пантокрин (по 30-40 капель 2 раза в сутки перед едой или по 1-2 мл подкожно или внутримышечно), настойка китайского лимонника (30-40 капель на прием 2 раза в сутки) и др.
Известно, что витамины необходимы для всех жизненных процессов. Хотя они и не являются пластическим материалом и не служат источником энергии, но при поступлении в организм оказывают влияние на течение биохимических процессов и иммуногенез при гнойно- воспалительных заболеваниях челюстно-лицевой области. Недостаток аскорбиновой кислоты ослабляет сопротивляемость организма больного и ухудшает течение воспалительного процесса. При этом отчетливо определяется влияние недостатка этого витамина на титр антител и на аллергические реакции. Восполнение недостатка аскорбиновой кислоты повышает фагоцитарную активность, усиливает образование антител, препятствует образованию гистамина и способствует гипосенсибилизации организма. Потребность организма в аскорбиновой кислоте у больных острыми гнойно-воспалительными заболеваниями увеличивается в 2-4 раза. В связи с нарушением питания больных с данной патологией у них наблюдается снижение содержания витаминов группы В, никотиновой кислоты. Ориентировочно считается, что большинство больных острыми гнойно-воспалительными заболеваниями должны получать в 2 раза больше витаминов, чем здоровые люди.
6. Физиотерапия
Физические факторы нашли широкое применение при лечении воспалительных заболеваний одонтогенной и неодонтогенной этиологии. Физиотерапевтическое воздействие оказывает раздражающее действие на рецепторы нервной системы, которые заложены в тканях. Раздражение нервных рецепторов передается в центральную нервную систему, вызывая изменения функционального состояния ее различных отделов, что отражается на течении физиологических и патологических процессов.
На ранних стадиях воспалительного процесса физиотерапия способствует разрешению заболевания, а при выраженном воспалении - его быстрому отграничению от окружающих здоровых тканей. Физические факторы позволяют стимулировать местные иммунобиологические реакции тканей, снижают явления общей и местной сенсибилизации, изменяют нейрогуморальные процессы в области патологического очага, усиливают локальное действие лекарственных веществ. Каждое местное физиотерапевтическое воздействие одновременно является и общим, так как реакция, которая возникает на ограниченном участке тела, всегда отражается на состоянии общей неспецифической резистентности организма.
Выбор физиотерапевтического метода лечения зависит от стадии развития и особенностей клинического течения воспалительного процесса, а также от состояния общей реактивности организма и наличия сопутствующих заболеваний.
Противопоказаниями к проведению физиотерапевтического лечения являются:
1. Местные
1) Острый гнойно-воспалительный процесс, при котором не проведена адекватная хирургическая обработка гнойного очага
2) Нарастание воспалительных проявлений в зоне воспаления
3) Склонность к кровотечениям из раны
4) Тромбофлебиты и флебиты вен лица или угроза их воспаления
5) Наличие в зоне предполагаемого воздействия опухолей и опухолеподобных состояний (в т.ч. кист)
2. Общие
1) Злокачественные новообразования другой локализации
2) Сердечно-сосудистые заболевания в стадии декомпенсации
3) Эпилепсия и заболевания ЦНС
4) Инфекции: туберкулез, ВИЧ, сифилис
5) Беременность
6) Заболевания крови (лейкоз, коагулопатия)
7) Высокая температура тела
8) Тяжелое общее состояние пациента
Благоприятное действие на ранней стадии воспалительного процесса оказывает местное применение тепла (согревающие компрессы, сухое тепло), которое усиливает активную гиперемию и реакцию тканей, повышает приток к очагу воспаления вместе с кровью фагоцитов и защитных гуморальных средств. Однако чрезмерный перегрев оказывает отрицательное действие на функцию фагоцитов и вызывает развитие в тканях лимфостаза, отека.
Известно, что сухое и влажное тепло способствует гиперемии и, особенно, лимфообращению. Отмечено, что лимфообращение усиливается лишь до определенной температуры тканей: сухое тепло до 46°С, влажное - до 42°С. При повышении температуры выше названных величин наблюдается замедление и остановка лимфообращения, что клинически проявляется нагноением.
М.Б. Фабрикант (1935) доказал, что гиперемия от припарок наступает через 1,5-2 часа, а от согревающего компресса - через 4-5 часов и удерживается более 24 часов. Ткани прогреваются на глубину от 1,8 до 3 см и в ней поднимается температура на 1,6-4,5°С. Поэтому становится понятным, что "горячие припарки" и частые смены согревающих компрессов приносят вред. По данным Н.А. Груздева (1976) при применении тепловых процедур у 68 больных воспалительными заболеваниями челюстнолицевой области в 84% случаев наблюдалось ухудшение (нагноение). П.Ф. Евстифеев (1959) указывает на отрицательный эффект при использовании у больных воспалительными заболеваниями грелок, согревающих компрессов.
Компресс накладывается на неповрежденную кожу. На рану накладывать компресс нельзя, т.к. увлажненная кожа легко мацерируется и инфицируется. Наряду с полуспиртовыми компрессами применяются повязки по Дубровину с 2% желтой ртутной мазью (А. И. Евдокимов, 1950), с мазью Вишневского (М.П. Жаков, 1969) и др. Мазь Вишневского (в виде компрессов) повышает местную температуру на 4-5°С, таким образом, вызывая большой риск нагноения воспалительного очага.
Следует помнить, что при бурном развитии воспаления дополнительное усиление гиперемии и экссудации с помощью тепловых процедур может привести к увеличению деструктивных изменений в тканях. Если произошло скопление гноя, то тепловые процедуры оказывают двоякое действие: с одной стороны, усиливают протеолитические процессы и ускоряют прорыв и опорожнение гнойника, а с другой стороны, при увеличивающемся скоплении гнойного экссудата и повышении давления внутри патологического очага, происходит распространение воспалительного процесса на другие клетчаточные пространства.
Снижению остроты воспалительных явлений способствует применение холода. Его использование вызывает сужение сосудов, уменьшает экссудацию и остроту воспаления. При поверхностном расположении очага холодовое воздействие (пузырь со льдом или холодной водой) назначается на короткое время (10-15 мин) с перерывами в течение 2 ч. Длительное применение холода нецелесообразно из-за возникновения нарушения питания тканей, гипоксии и венозного застоя, значительно ухудшающих течение воспалительного процесса. Для лечения серозных лимфаденитов гипотермию использовала И.Л. Чехова (1994).
В серозной стадии одонтогенных воспалительных заболеваний челюстей и мягких тканей в целях уменьшения остроты воспалительных проявлений и боли применяют электрическое поле ультравысокой частоты (УВЧ). В этот период назначают олиго - или атермические дозы УВЧ, для чего используют минимальную мощность аппарата, минимальный размер конденсорных пластин и максимальное удаление от воспалительного очага. При назначении термической дозы УВЧ (максимальная мощность аппарата и размер конденсорных пластин, максимальное приближение к патологическому очагу) может возникнуть обострение процесса, что используется с провокационной целью при длительном его течении. Термические дозы способствуют рассасыванию воспалительных инфильтратов. При этом отмечается выраженное сосудорасширяющее действие, в основе которого лежит глубокое прогревание тканей. Данное обстоятельство заставляет отказаться от применения термической дозы УВЧ при возможности кровотечения из раны. Олиготермическая дозировка УВЧ способствует улучшению репаративных процессов в области патологического очага, стимулирует функцию парасимпатической системы и угнетает симпатическое влияние, что благоприятно сказывается на течении воспалительного заболевания. Атермическая и олиготермическая дозы УВЧ применяются для ускорения отторжения некротически измененных тканей и перехода гнойной раны в регенеративную фазу. Этот вид лечения можно проводить, не снимая с раны повязки. После того как стенки и дно раневой поверхности выполняются грануляционной тканью, воздействие УВЧ должно быть прекращено, так как дальнейшее его применение может привести к быстрой дегидратации и уплотнению тканей, что тормозит регенерацию и способствует образованию плотного рубца.
Для предупреждения распространения инфекции и рассасывания воспалительного инфильтрата рекомендует назначать ультрафиолетовое излучение (УФО) в эритемной дозе, которое может быть применено сразу после воздействия ЭП УВЧ. Ультрафиолетовые лучи вызывают так называемый фотоэлектрический эффект, при котором за счет энергии поглощенных фотонов из атомов высвобождаются электроны, являющиеся носителями энергии в виде электромагнитного поля и оказывающие стимулирующее действие на биологические процессы в очаге воспаления. УФО стимулирует некоторые реакции иммунитета и обладает бактерицидным действием. УФ- лучи оказывают благоприятное действие на регенеративную фазу раневого процесса, особенно при вялом течении заживления, бледных маложизнеспособных грануляциях, задержке эпителизации. Раны с хорошими мелкозернистыми грануляциями розового цвета облучают небольшими дозами УФО (1-2 биодозы) с интервалом 3-4 суток. При вялых, рыхлых грануляциях с обильным отделяемым назначают большие дозы УФО (3-4 биодозы) с интервалом 5-6 суток. После начала эпителизации воздействие УФ- лучами становится излишним и даже вредным. По мнению Н.А. Груздева (1978), наибольший эффект дает применение УФО на область рефлексогенной зоны (надключичная область и надплечье соответствующей стороны). При торпидно протекающем процессе этот фактор способствует усилению воспалительной реакции.
Д. В. Дудко и В. В. Макарени (1982) рекомендуют после вскрытия одонтогенных абсцессов и флегмон назначать лечебную гимнастику мышц лица, которая оказывает общее тонизирующее воздействие на организм, усиливает местное кровообращение, содействуя резорбтивным и гидратационным процессам в области послеоперационной раны, предотвращает развитие деструктивно-атрофических изменений в околосуставных тканях и образование контрактуры височнонижнечелюстного сустава. Авторы рекомендуют больному (в период острого воспаления) несколько раз максимально открывать рот, выполнять боковые и круговые движения в суставе, а для улучшения оттока экссудата — периодически лежать на стороне разреза. Предложен комплекс упражнений, зависящих от фазы течения воспалительного процесса.
Применение рентгенотерапии при воспалительных заболеваниях обосновано как экспериментальными, так и клиническими наблюдениями. В ранней стадии воспалительного процесса рентгенотерапия ведет к уменьшению периваскулярного отека и ускорению резорбции токсических продуктов, способствует расплавлению и отторжению некротизированных тканей, усиливает рост грануляций и эпителизацию кожи. При острых воспалительных процессах назначают однократную очаговую дозу 10-40 рад с интервалом 3-5 суток. Рентгенотерапия противопоказана детям и беременным женщинам. Не допускается сочетание рентгенотерапии с физио- и бальнеотерапией, между их проведением должен быть промежуток не менее 3-4 недель (И.Л. Переслегин,1979).
Для лучшего проникновения лекарственных веществ в глубоко расположенные ткани используют электрофорез с лекарственными препаратами. Для электрофореза в острой стадии воспалительного процесса применяются антибиотики (препараты пенициллинового ряда и др.), обезболивающие (новокаин, тримекаин, лидокаин) и рассасывающие средства (йодид калия, лидаза, ронидаза и др.), протеолитические ферменты (трипсин, химотрипсин, химопсин и др.), антикоагулянты (гепарин), витамины, а также другие лекарственные средства.
В целях повышения эффекта электрофорез ранее указанных препаратов можно сочетать с ультразвуком или использовать фонофорез.
Ультразвук представляет собой высокочастотные колебания частиц твердой и газообразной среды с частотой колебаний выше 20 кГц, то есть выше порога слышимости. Ультразвук оказывает болеутоляющее, спазмолитическое, фибринолитическое, гипосенсибилизирующее и нейротрофическое действие. Ультразвуковую терапию проводят с помощью отечественных препаратов УТП-1 и УТП-3. В.М. Модылевский (1985) рекомендует при лечении острого одонтогенного периостита использовать малые дозы ультразвука (0,2 Вт/см2) с последующим их повышением до средних доз (не более 0,6 Вт/см2). Курс лечения состоит из 2-5 сеансов длительностью 6-8 мин. Автор рекомендует начинать лечение с интенсивностью 0,2 Вт/см2 и через 2-4 мин увеличивать дозу до 0,4 Вт/см2. При отсутствии болевых ощущений в области воздействия со второго сеанса дозу увеличивают до 0,6 Вт/см2, воздействуют на протяжении 10 мин. Аналогичные дозы ультразвука применялись при острых одонтогенных лимфаденитах. Уже через 1-2 сеанса ультразвука значительно уменьшилась припухлость, стихала боль, понижалась местная и, обещая, температура тела, что способствовало сокращению сроков лечения больных данной группы.
Введение лекарственных веществ с помощью ультразвуковых колебаний получило название фонофореза. Однако этот метод еще не имеет достаточно широкого применения. Получен положительный эффект при использовании фонофореза гидрокортизона на область воспалительного инфильтрата при лимфадените. Хорошие результаты наблюдались при использовании фонофореза гидрокортизона и лидазы на область послеоперационных рубцов. Воздействовали на патологический очаг один раз в сутки, ежедневно.
Изучено влияние на течение гнойного раневого процесса лазерного воздействия малой мощности. О клинических изменениях судили по цитологической карте ран. Для проведения лазерной терапии в клинике используют гелий-неоновый лазер малой мощности ЛГ-75-1. Выявлено, что применение лазерного излучения целесообразно только в регенеративной фазе раневого процесса, так как использование его в фазе гнойно-некротических изменений может обострить воспалительный процесс (вызывает изменения проницаемости сосудов). Цитологическая картина ран при лазерном воздействии значительно отличалась от таковой при лечении общепринятыми методами (контрольная группа). Под воздействием малой мощности лазерного излучения уже к третьему дню облучения эритроциты встречались в мазках-отпечатках изредка, в контрольной группе они обнаруживались до 5-6-го дня. Нейтрофильные лейкоциты изменяли свою структуру (исчезали дегенеративные формы), появлялись жизнеспособные нейтрофильные лейкоциты. Если при лечении общепринятыми методами в отпечатках к 5-6-му дню обнаруживаются лишь единичные макрофаги и гистиоциты, а фибробласты встречаются лишь к 7-8-му дню течения раневого процесса, то под воздействием лазерного излучения цитологическая картина изменялась и была следующей: на 2-е -3-й сутки облучения количество макрофагов в препарате нарастало до 3-5, а к 5-6-му дню их число уменьшалось до 1-2 (что свидетельствует о завершении очищения раны); гистиоциты обнаруживались уже в первые дни и в последующем их число значительно увеличивается; на 4-5-е сутки выявлены фибробласты. Данные цитологических исследований были использованы как критерий возможности наложения на рану вторичных швов. При облучении гелий-неоновым лазером больных абсцессами и флегмонами челюстно-лицевой области и шеи, воспалительный инфильтрат уменьшался быстрее, что дало возможность наложить швы уже на 5-6-е сутки. Лазерная терапия оказывается эффективной и при лечении острых неспецифических лимфаденитов, так как она обладает отчетливо выраженным противовоспалительным и обезболивающим действием. Антимикробным действием лазерное излучение не обладает. (А.А. Тимофеев, 1986-1989).
В последние годы экспериментально и клинически доказано, что противовоспалительное действие лазерного излучения и постоянного магнитного поля проявляется более эффективно при одновременном (сочетанном) воздействии на патологический очаг, чем при раздельном или последовательном применении указанных физических факторов (А. К. Полонский и соавт.. 1984). Методика магнитолазерной терапии заключается в следующем: на патологический очаг накладывают кольцевидные ферритовые магниты и одновременно проводят облучение лазерным излучением малой мощности. Положительный эффект получен для стимуляции регенеративных процессов при лечении переломов нижней челюсти и профилактики развития посттравматического остеомиелита. Однако данная методика еще не нашла широкого применения в клиниках челюстно-лицевой хирургии.
Широкое использование находит применение постоянного и переменного магнитного поля, которое оказывает противовоспалительное, обезболивающее и регенерирующее действие.